化学を勉強したことのある人であれば、アンモニアが弱塩基であることはご存知でしょう。
では、なぜアンモニアが弱塩基なのか?
その理由を問われて、自信をもって回答できるでしょうか?
そこで、アンモニアが弱塩基である理由を考えていきたいと思います。
何を根拠に「アルカリだ!」と言えるのか?
1887年にスウェーデンのスヴァンテ・アレニウスが酸・塩基について、次のように考えました。
水に溶けて水素イオン(H+)を出す物質を酸
水に溶けて水酸化物イオン(OH-)を出す物質を塩基
たしかに、水酸化ナトリウムは水溶液中で電離してOH
-を出します。
NaOH → Na+ + OH-
ところが、アンモニアは電離しないのでOH
-を出せません。
アレニウスの考えではアンモニアを塩基と考えるのは、少し無理があります。
アレニウスの定義から30年以上が過ぎたころ、デンマークのヨハンス・ブレンステッドがより現実的な酸と塩基の定義を提案しました。
(その頃、英国のマーチン・ローリーも彼と同じ考えを発表しました。)
何かに水素イオン(H+)を与える物質を酸
何かから水素イオン(H+)を受取る物質を塩基
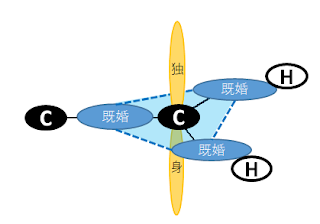
アンモニアは下の図のように、窒素が非共有電子対を持っているので、H
+を受取りやすい性質があります。
ですから、H
+を受取るアンモニアは
塩基といえます。
ところで、アンモニアは何からH
+を受取っているのでしょうか?
答えは水(H
2O)です。
となると、アンモニアにH
+を与える水は
酸といえます。
このとき、アンモニアとH
+を受取ったアンモニウムイオンの関係を
共役の関係といいます。
そして、H
+を受取ったアンモニアは
共役酸、H
+を失った水は
共役塩基となります。
H+を与えた(失った)物質のことを共役塩基
H+を受取った物質のことを共役酸
ついでに、水酸化ナトリウムも例にして考えてみましょう。
水酸化ナトリウムが水に溶けるとNa
+とOH
-に電離します。
電離したOH
-に水がH
+を与えるので、水は酸となり残りのOH
-は水の共役塩基となります。
その一方で、生成した水は水酸化ナトリウムの共役酸となります。
そして、酸でも塩基でもないNa
+は
無関係イオンといいます。
強塩基と弱塩基の違いは何?
これまで見てきたように、アンモニアも水酸化ナトリウムも水に溶けたとき、
必ずOH-を生みます。ただし、アンモニアと水酸化ナトリウムとでは、生み出すOH
-の量が異なります。
強塩基といわれる水酸化ナトリウムが水に溶けると、ほぼ完全にNa
+とOH
-に電離しますが、弱塩基といわれるアンモニアが水に溶けると、一部のアンモニアがH
+を受取ってアンモニウムイオンとなり、それと同じ量だけのOH
-が生まれます。
つまり、
強塩基が生み出すOH-の量 > 弱塩基が生み出すOH-の量
という図式が成立します。
次に、塩基の強弱の定量化を考えてみよう。
アンモニア水はビーカーの中で、次のような平衡状態となっています。
このとき、温度が一定であれば左辺と右辺のそれぞれの濃度の関係は次のようになり、このときの「K
c」を
濃度平衡定数といいます。
ここで、溶媒である[H
2O]に注目してください。
溶媒である[H
2O]は、溶質である[NH
3]、[NH
4+]、[OH
-]と比較して、その物質量が圧倒的に多いため、一定とみなします。(活量=1として無視します。)
「左辺には定数、右辺には変数」
でまとめたいので、[H
2O]は左辺に移動します。
ここで「K
c」とは異なる新しい定数「K
b」が誕生しました。この「K
b」を
塩基の電離定数といいます。(ちなみに、酸の電離定数は「K
a」です)
塩基が強い物質ほど多くのOH
-を生み出すので、分子は大きくなります。ですから、
Kb値が大きくなるほど、塩基が強いことを表します。
次の数値は25℃におけるアンモニアとアニリンのK
b値です。アンモニアのほうがアニリンよりも塩基が強いことがわかります。
アンモニア:K
b=1.8×10
-5
アニリン:K
b=4.0×10
-10
とはいっても、数値が小さくて比較しづらいので、pK
b (=-log
10K
b) を使うことが多いです。
アンモニア:pK
b = 4.74
アニリン:pK
b = 9.40
Kb値は実際にはそれほど使われない...
ところが、K
b値は実際にはそれほど使われていません。使われているのは、K
a値です。
これは、アンモニアではなくアンモニウムイオン(アンモニアの共役酸)の酸性度をみているので、反応式は次のようになります。
この反応に対して、電離定数は次のようになります。
酸の強さは、H
2OにH
+を渡す強さです。
ですから、
酸が強いほど分子が大きくなり、Ka値も大きくなります。
ここで、25℃におけるアンモニアとアニリン、それぞれの共役酸のK
a値とpK
a値をみてみましょう。
アンモニアンモニアの共役酸:K
a=5.6×10
-10
pK
a=9.25
アニリンの共役酸:K
a=2.5×10
-6
pK
a=4.63
塩基度はアンモニアのほうがアニリンよりも強いので、K
a値はアンモニアの共役酸よりもアニリンの共役酸のほうが大きくなります。
<参考文献>
J.N.Spencer ほか『スペンサー基礎化学』東京化学同人(403~419)
亀田和久『大学入試 亀田和久の理論化学が面白いほどわかる本』(128~137,394~396)