1.電子殻の内側には電子が住むアパートがある⁉
メタンやエチレン、アセチレンなどの構造図をみると、炭素には結合できる手が4本あることに気づきます。
そして、原子番号が6である炭素には全部で6個の電子があり、そのうちの2個がK殻に、残りの4個がL殻に配置されています。
ここまでは高校で学習する内容ですが、高校を卒業するとK殻やL殻といった電子殻のさらに内側にまで学習範囲が広がります。
ここからは話を分かりやすくするために、炭素原子の内側に図のような2階建てのアパートがあると想像してください。このアパートの住人は電子です。
このアパートでは1階のことを『K殻』、2階のことを『L殻』とよび、K殻には家賃の安い『S』タイプの部屋が1つ、L殻には家賃が標準の『S』タイプの部屋が1つと家賃の高い『P』タイプの部屋が3つあり、アパート全部で5つの部屋があります。
どの部屋も定員が2名(電子2個)という決まりがあるので、アパート全体では最大10名(電子10個)が利用できます。
次に、アパートの住人である電子について説明しましょう。彼らには3つの性質があります。
- 安い部屋に住むことに価値があり、そのためならルームシェアをする。
- しかし、可能ならルームシェアは避けたい。
-
同じアパートの住人同士とは距離を取りたがるが、他所のアパートの電子と何らかの関係を結びたがる。
これらを踏まえて、このアパートの住人たちの部屋割りを考えると次のようになります。
ちなみに、電子は『↑』で表し、相部屋の場合は『↑↓』のように、矢印を逆向きに表します。
最も家賃の安い1階の『S』タイプの部屋は、2人の電子がルームシェアをします。次に家賃の安い2階の『S』タイプの部屋も同様です。最も家賃の高い『P』タイプの部屋は3つあるので、ルームシェアを避けます。
電子が独りで住んでいる部屋が2つありますね。これが不対電子です。
でも、高校では炭素原子の原子価は4価と習ったので、不対電子は4つのはずです。おかしいと思うかもしれませんがこの状態を
基底状態といい、高校で習った不対電子が4つの状態を
励起状態といいます。
2.励起状態とは?
励起状態を理解するには、婚活に例えるのが良いかもしれません。2階の住人たちが婚活をはじめたとしましょう。ルームシェアをしていたら、婚活が思うように上手くいきませんので、2階の『S』タイプの住人はルームシェアを解消することにします。ひとりが空き部屋である『P』タイプの部屋に引っ越すことになるので、これまでよりも多くの家賃を払うことになります。
このように、婚活のために家賃の高い部屋に引っ越した状態のことを励起状態といいます。
3.SP3混成軌道とは?
2階の住人たちが婚活をはじめたことで励起状態となり、不対電子が4つになりました。ところが、問題が1つあります。電子には
安い部屋に住むためなら、ルームシェアをするという性質があるほど安い部屋が大好きです。そのため、婚活市場においても家賃が安い部屋に住んでいることが重視されます。ですから、家賃の高い『P』タイプよりも家賃の安い『S』タイプに住んでいる電子のほうが婚活では有利です。
そこで、住人たちの婚活を応援したいアパートの大家さんは、家賃を見直すことにしました。『Pタイプ』の家賃を下げ、『Sタイプ』の家賃を上げることで、『Pタイプ』と『Sタイプ』の家賃を同一にしたのです。この家賃を同一にした部屋のことを
混成軌道といい、今回は『Sタイプ』と3つの『Pタイプ』が同一になったので、
SP3混成軌道といいます。
大家さんの粋な計らいによって、2階の住人たち全員の婚活は成功し、水素由来の電子と暮らすことになりました。つまり、メタンの完成です。
このように、婚姻関係に基づいた電子同士の結合のことを σ 結合とよびます。婚姻関係は法律に基づいた関係でもあるので、その結合力は強力で安定しています。
ここで少し視点を変えて2階の住人たちの心理的な距離感を考えてみます。
各部屋の電子たちは同じマンションの住人同士ですが、
他人に干渉したくないし、干渉されたくもないというのが本音です。そこで、4つの世帯が可能な限り立体的に等しく距離を置こうとすると、必ず正四面体の形になります。つまり、
SP3混成軌道は正四面体構造といえます。
4.SP2混成軌道とは?
ところで、2階の住人のうち1人だけ婚活しない場合はどうなるのでしょうか?
アパートの大家さんは婚活をしている住人の部屋だけしか家賃を変えません。ですから、アパートの料金体系は次のようになります。これを
SP2混成軌道といいます。
またもや大家さんの粋な心遣いによって3人の婚活は成功しました。3人のうちの2人は水素原子由来の電子と結婚し、もう1人は炭素由来の電子と結婚しました。
このときの2階の各部屋の心理的な距離感も考えてみましょう。
他人にあまり干渉したくないし、干渉されたくもないという電子の性質は基本的に変わらないので、可能な限り等しく心理的に距離を置きます。
しかし、SP
3のときと異なり2階の住人全員が
既婚者(夫婦)ではありません。日常生活でもそうですが、
既婚者(夫婦)と独身者との間には特別な距離感が生まれます。
既婚者同士は同じ平面上でお互いに等しく距離を保った結果、
正三角形の構造になります。一方、独身者は可能な限り既婚者たちと関わらない位置(
既婚者の平面に対して垂直の位置)をキープします。
こんな独身者ですが、他所のアパートの独身者とは何らかの関係を結びます。この関係を π 結合(二重結合)と呼びます。
π 結合(二重結合)は σ 結合のように法律に基づいた結合(婚姻関係)ではないので、その関係は壊れやすく、不安定なのが特徴です。
5.SP混成軌道とは?
最後に、2階の住人のうち2人が婚活をはじめた場合を考えてみましょう。
アパートの大家さんは婚活をしている住人の部屋だけしか家賃を変えませんから、アパートの料金体系は次のようになります。これを
SP混成軌道といいます。
大家さんの粋な心遣いによって2人の婚活は成功しました。2人のうちの1人は水素原子由来の電子と結婚し、もう1人は炭素由来の電子と結婚しました。
次に、このときの2階の各部屋の心理的な距離感も考えてみましょう。
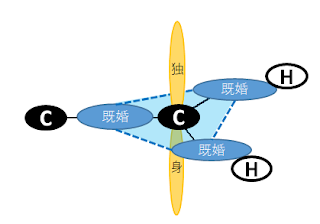
既婚者同士は同じ平面上で互いに等しく距離を保つため、1本の線構造になります。一方、独身者の二人は可能な限り他の人たちと関わらない位置をキープした結果、下の図のような形になります。
先ほども話しましたが、こんな独身者でも他所のアパートの独身者と何らかの関係を結びます。この関係が π 結合(三重結合)です。
6.まとめ
7.参考文献
岡島光洋『理系なら知っておきたい化学の基本ノート[物理化学編]』中経出版(25~33,101~106ページ)
亀田和久『亀田講義ナマ中継有機化学』講談社サイエンティフィック(10~23ページ)
8.わかりやすい動画